OPR&D综述:P-手性二氢苯并氧磷杂环戊烷膦配体促进的催化与合成(下篇)[1]


OPR&D综述:P-手性二氢苯并氧磷杂环戊烷膦配体促进的催化与合成(下篇)[1]

上篇推文,我们介绍了P-手性二氢苯并氧磷杂环戊烷膦配体在Suzuki-Miyaura偶联反应中的应用情况(上篇),本文则将介绍此类配体促进的不对称氢化反应。在不对称氢化反应中,手性双膦配体是最常用的一类配体,其中P-手性双膦配体扮演了重要角色,在多种不对称氢化反应中表现出色,具有对映选择性高,催化效率好的优点,经常能获得很高的催化转化数(TONs)。
1
烯酰胺的不对称氢化
自从BIBOP类型的P-手性双膦配体合成出来开始,研究者就发现了其在烯酰胺的不对称氢化方面具有非常高的活性和对映选择性,如图1所示。在BIBOP的催化下α-芳基取代的烯酰胺和α-酰胺取代的丙烯酸酯类底物均实现了高效的不对称氢化,TON可达2000(如图1A)。[2]MeO-BIBOP则在一个含溴的α-芳基烯酰胺底物的不对称氢化中显示出极高的催化效率,在公斤级反应规模上可达到200000TON!在如此低的催化当量下,催化剂的成本在药物合成中的占比将变的非常低,成为次要考虑因素(如图1B)[3];此催化体系能兼容杂环底物,在0.01mol%的催化剂当量下,实现吡啶取代烯酰胺的不对称氢化(如图1C)[4]。在BIBOP的4-和4’-引入蒽基,研究团队发展了强大的WingPhos,此配体与Rh组成的催化体系能完成一系列三取代β-芳基酰胺的不对称氢化,链状或环状(杂环)烯酰胺均可兼容(如图1D)[5]。继续对BIBOP的4-和4’-进行修饰,研究团队获得了结构独特的ArcPhos,该配体搭配Rh前体能实现脂肪环状四取代烯酰胺的首次不对称氢化,采用该方法,能方便地合成一系列手性顺式2-烷基取代的环状(碳环或杂环)胺类衍生物[6,7]。
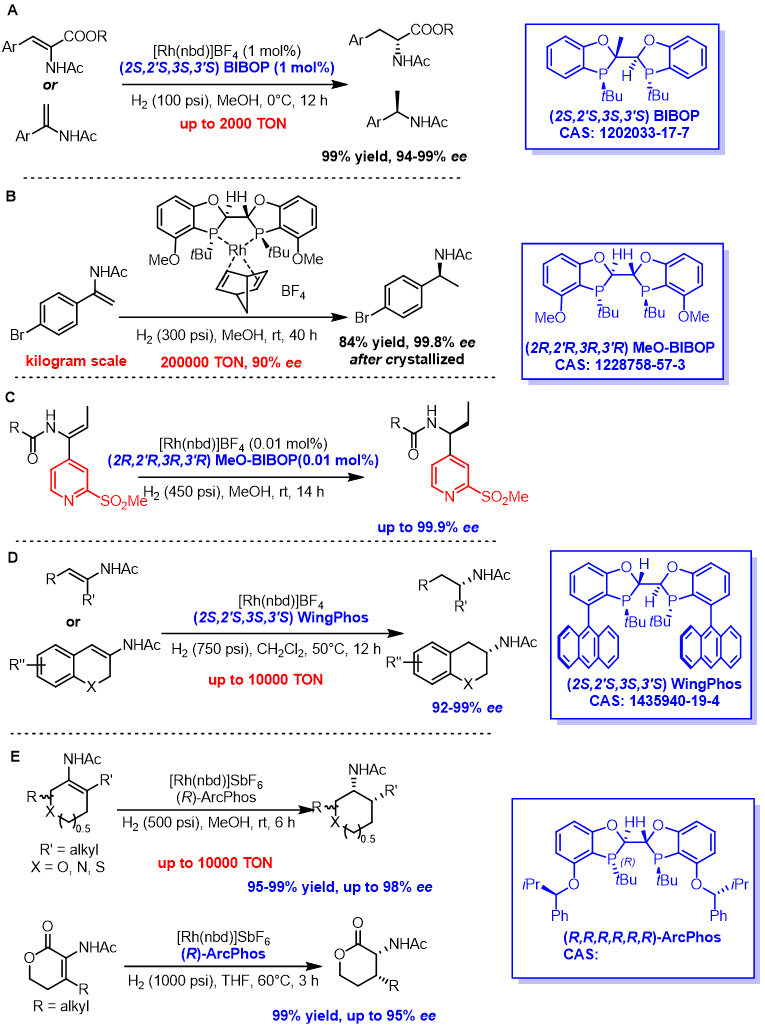
图1.Rh/BIBOP类型双膦配体
催化的稀酰胺不对称氢化反应
与BIBOP类配体左右自偶联不同,将两分子P-手性二氢苯并氧磷杂环戊烷上下自偶联则可获得另一类双膦配体BABIBOP,如图2所示。BABIBOP类双膦配体同样在烯酰胺的不对称氢化方面具有独特的应用前景,能兼容各种官能团。更重要的是在某些底物中与BIBOP可形成很好的互补,进一步拓宽了此类配体在烯酰胺不对称氢化领域的普适性[8]。

图2. Rh/BABIBOP类型双膦配
体催化的烯酰胺不对称氢化反应
对P-手性二氢苯并氧磷杂环戊烷核心骨架进一步结构拓展,在氧磷杂环片段中氧、磷原子之间的亚甲基上引入磷取代基,研究团队发展了新颖的POP类型双膦配体,如图3所示,该类配体在α-(酰胺基)-丙烯酸酯和β-(酰胺基)-丙烯酸酯类化合物的不对称氢化中具有非常高效的表现。以(2S,3R)-MeO-POP和[Rh(nbd)]BF4为催化剂,可以几乎定量的产率,以97-99%的ee值实现一系列烯酰胺底物的不对称氢化,完成了多种手性氨基酸衍生物的制备,催化剂转化数可高达10000[9]。
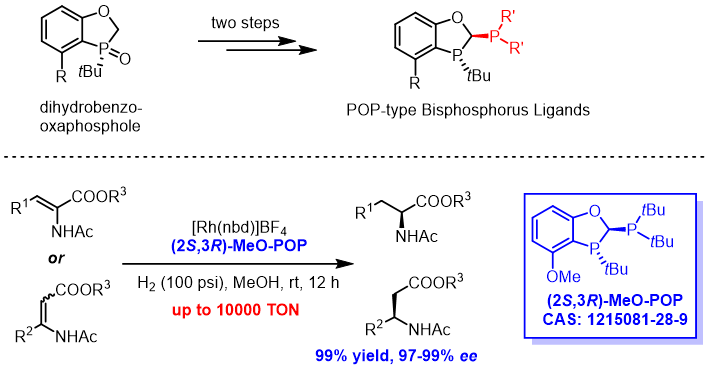
图3. Rh/POP类型双膦配体催
化的稀酰胺不对称氢化反应
2
多取代烯烃的不对称氢化
P-手性二氢苯并氧磷杂环戊烷膦配体在多取代烯烃的不对称氢化中有广泛应用。研究团队在氧磷杂环片段中氧、磷原子之间的亚甲基上引入一系列取代噁唑环,可得到多种P-手性磷氮配体(图4A),并在1-芳基-3,4-二氢萘及环外亚胺类底物的不对称氢化中显示了优秀的活性和对映选择性[10]。该研究团队进一步在氧、磷原子之间的亚甲基上引入取代吡啶环,合成P-手性二氢苯并氧磷杂环戊烷磷氮配体(图4B),可以实现三取代或四取代烯烃的不对称氢化,该催化体系对于环状或非环状底物均可使用[11]。以Ir/ Bis-BIDIME为催化剂,可实现1,4-苯并二噁英的不对称氢化,制备2-取代苯并二噁烷(图4C)[12]。
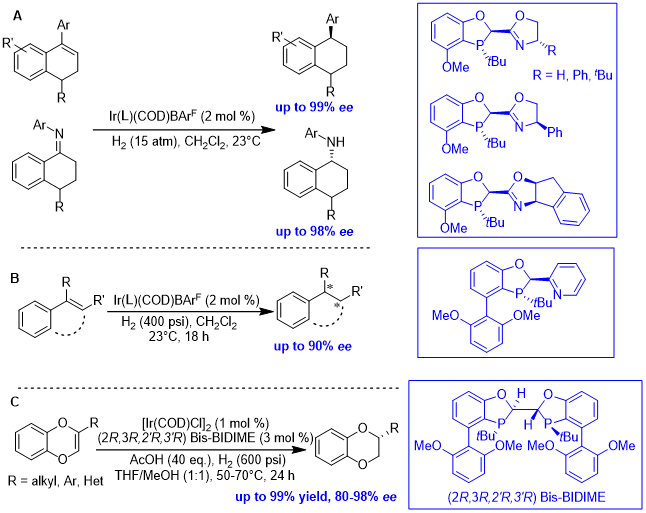
图4. Ir催化多取代烯烃的不对称氢化反应
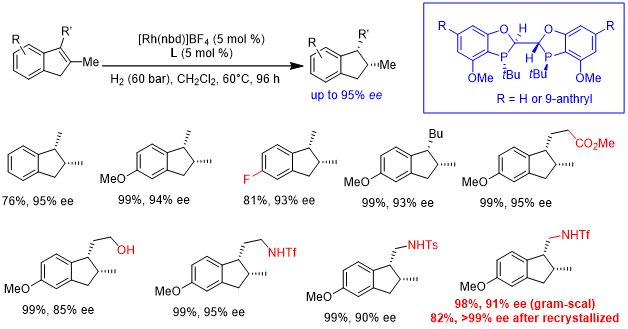
图5. Rh/BIBOP类型双膦配体催化
的四取代烯烃的不对称氢化反应
3
羰基的不对称氢化
羰基还原是一类关键的化学转化,尤其是通过羰基的不对称还原合成手性醇类化合物无论是在学术界还是在工业界都是极为重要的。其中直接将羰基进行不对称氢化无疑是一种经济、高效、直接的的方式。P-手性二氢苯并氧磷杂环戊烷双膦配体在羰基的不对称氢化中有不俗的表现。
勃林格殷格翰研究团队在一个胆固醇转运蛋白抑制剂中间体的合成工艺升级案例中生动的揭示了BIBOP类型双磷配体在羰基不对称氢化中的巨大应用潜力。如图6所示,在该案例中,老工艺采用有机小分子催化羰基的不对称还原,尽管在公斤级的反应中该工艺能保持稳定,以较好的收率和对映选择性获得所需产物,然而该反应需要15%的催化剂载量,一旦催化剂当量降低,反应就无法完全转化,高昂的催化剂成本制约了该工艺的进一步放大。于是研究团队发展了MeO-BIBOP与手性双胺的钌络合物,成功的解决了老工艺催化剂当量过高的弊端,实现工艺升级。在新工艺中,催化剂当量可降低到0.01%,且极大的提高产物的产率和对映选择性,在0.5公斤规模的反应中,TON甚至可高达20000。更低的催化剂用量,更高的产率和对映选择性,不仅减少了催化剂成本,更避免了珍贵底物浪费,且大大简化后处理操作,节约人工和时间成本。在该研究中,通过调整MeO-BIBOP与不同双胺化合物的组合,还原产物的两种构型均可高对映选择性的获得。通过底物拓展,研究团队发现此还原体系能兼容多种含杂环的酮类化合物的不对称氢化,TON最高可达100000,体现了该催化体系的普适性和高效性[14,15]。

图6. Ru/BIBOP/双胺络合物
催化的羰基不对称氢化反应
除了BIBOP类型,BABIBOP类型的双膦配体也可用于羰基的不对称催化反应。如图7A所示,以iPr-BABIBOP和Pd(TFA)2为催化剂,可实现β-酮酸酯的不对称氢化,制备一系列β-羟基取代的酯类化合物[16]。在BABIBOP基础上发展的N-BABIBOP与廉价的铜组合,可通过动态动力学拆分实现2-取代四氢萘类化合物的不对称氢化,高对映选择性/非对映选择性地合成一系列具有两个连续手性中心的醇类化合物,其对映选择性/非对映选择性可达98:2 er和 >99:1 dr值(图7B)。研究团队通过对比发现,在此类底物中,N-BABIBOP的催化效果要优于BIBOP和O-BABIBOP,因此在某些特定底物中可作为后两者的补充[17]。
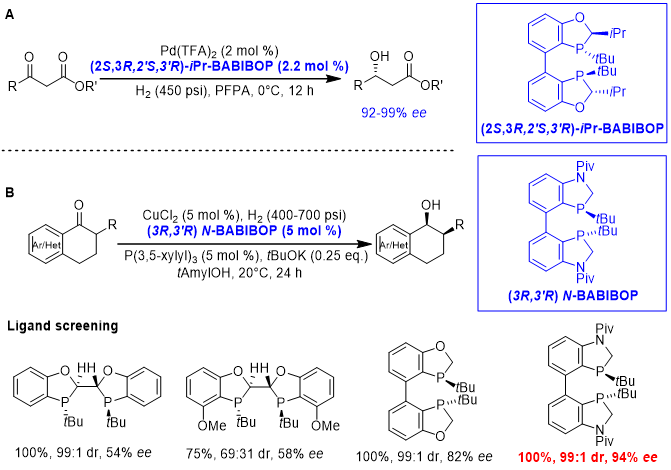
图7. BABIBOP类型双膦配体
促进的羰基不对称氢化反应
4
芳环的不对称氢化类
芳香化合物的不对称氢化长期以来是合成化学领域的重点和难点。研究团队发展的MeO-BoQPhos能顺利实现α-芳基(或杂芳基)取代的吡啶盐高效、高对映选择性的不对称氢化,合成一系列在药物分子中有重要价值的手性α-芳基(或杂芳基)取代哌啶类化合物。与众多著名的轴手性双膦配体相比,MeO-BoQPhos显示了远超其它配体的对映选择性(图8A)。底物普适性研究则显示该催化体系在多种杂环底物中均可兼容(图8B) [18]。此催化体系被成功地运用到一个11β-HSD-1抑制剂的合成中(图8C),作为其中的关键步骤,在公斤级规模上完成了茚吡啶盐的不对称氢化,从而在百公斤级的原料药合成中将成本降低40% [19]。此案例生动的凸显了合适的催化体系在药物合成中的重要性。
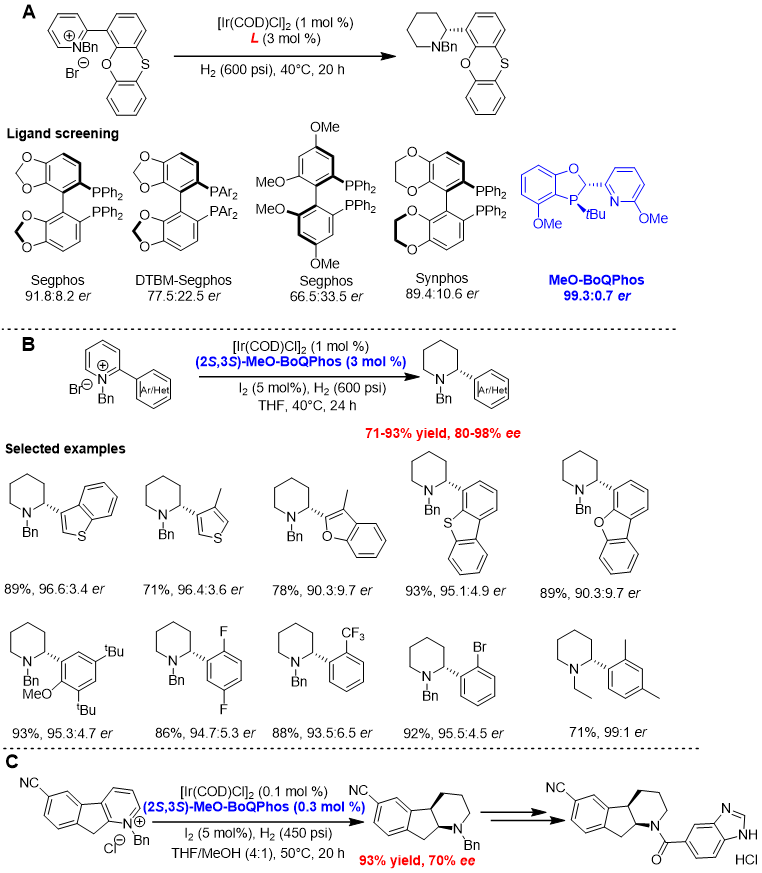
图8.Ir/ MeO-BoQPhos催化吡啶盐的不对称氢化
双膦配体WingPhos也可应用于芳环的不对称氢化中。以Rh/ WingPhos为催化剂,可实现全碳芳环的不对称氢化,通过去对称化或动力学拆分的方式合成一系列轴手性化合物。WingPhos独特的分子结构和富电子特性是该反应能保持高活性和高对映选择性的关键因素[20]。该研究小组随后又报道了Pd/ WingPhos催化吲哚类化合物的不对称氢化,合成了一系列3-取代的二氢吲哚类化合物[21]。
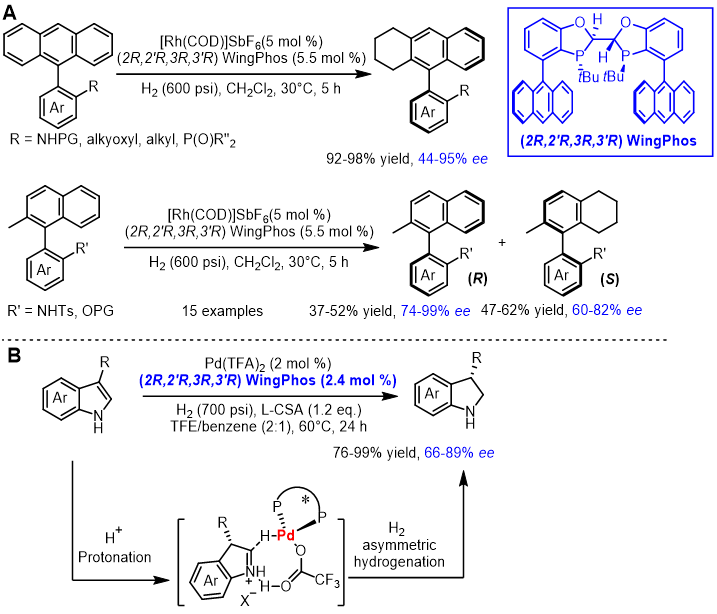
图9. WingPhos催化芳环的不对称氢化
近年来,绍兴赜军医药科技有限公司以P-手性二氢苯并氧磷杂环戊烷为骨架发展了一系列结构丰富多样的双膦配体。其中BIBOP类、BABIBOP类、POP类都在不对称氢化方面有很好的应用,尤其是在烯酰胺的不对称氢化方面可说是大放异彩,具有化学和立体选择性好、催化剂载量低、底物普适性广、反应条件温和、大部分产品对空气稳定、操作便捷等优点。三类配体针对不同底物互相补充,极大的拓宽底物普适性,能合成大量手性氨基酸衍生物。目前绍兴赜军医药科技有限公司已实现多种双膦配体年产数十公斤级的供应能力,产品面向全球。
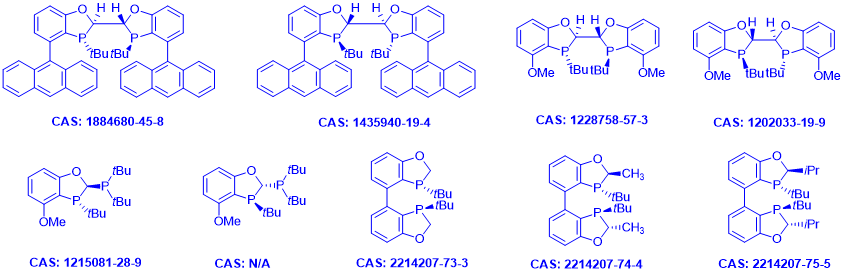
图10. 赜军医药科技有限公司的特色双膦配体(部分)
注:
1. Org. Process Res. Dev. 2024, 28, 949-977.
*更多产品信息,请访问:www.zejunpharma.com










